
PROTAC药物因可靶向“不可成药”靶点成为了生物医药领域研究的焦点,带动了蛋白质降解技术的快速发展,衍生了“万物皆可降”的说法。蛋白质的积聚与神经退行性疾病相关,蛋白质降解技术的发展能否为神经退行性疾病的治疗带来新希望?
10月28日,上海市药物研发协同创新中心与浦东国际人才发展中心共同举办第44期 science café活动。本期特别邀请了上海领泰生物医药科技有限公司创始人兼CEO冯焱博士和中科院生物化学与细胞生物学研究所胡红雨教授,为大家分享PROTAC技术新药研发机遇和挑战、以及蛋白质积聚引发神经退行性疾病的机制和新药设计的思考。
以下是嘉宾报告精彩内容:
1
PROTAC新药研发机遇和挑战
冯焱博士从技术的角度分享了PROTAC药物开发现状、面临的挑战、以及未来发展前景,指出了“万物皆可降”的蛋白质降解技术前景可期。
蛋白质降解技术是利用人体内泛素蛋白酶系统,将错误折叠或错误表达的致病蛋白通过泛素化降解途径清除掉。作为蛋白质降解技术之一,PROTAC技术的优势在于药物剂量低和可靶向“不可成药”靶标。PROTAC药物通过促进“泛素连接酶-PROTAC-靶蛋白”三元复合物的形成,引发靶蛋白泛素化降解,在这个过程中PROTAC药物分子起到了催化作用,且可反复循环使用,因此PROTAC药物分子的暴露量要求低。同时,PROTAC分子与靶蛋白结合力要求低,无需药物分子结合到靶蛋白活性位点,因此可靶向传统上“不可成药”的靶点。
纵观发展历程,PROTAC发展可分为三个阶段,2001年Sakamoto等人首次提出Pproteolysis-targeting chimera (PROTAC)概念,因早期PROTAC分子基于多肽设计,透膜性差,难以实现细胞内靶蛋白质的有效降解,PROTAC发展较为缓慢。直至2008年第一个小分子PROTAC诞生,体内降解活性首次得到验证,为后续小分子PROTAC的设计打开了大门。但此时PROTAC分子与成药距离仍较远,直至2014年免疫调节酰亚胺药物(IMiDs)与CRBN(泛素E3连接酶的一种衔接蛋白)结合结构被揭示,PROTAC分子得到了快速发展。随后,在2019年Arvinas公司将首个PROTAC药物ARV-110推上临床,PROTAC正式迈入第二个发展阶段,一系列PROTAC产品不断涌现。到了2021年,多家制药公司的PROTAC药物相继进入临床,蛋白质降解技术迎来全面发展阶段。根据智慧芽数据库的数据,从PROTAC技术相关的文章和专利数量显示,2015年后PROTAC技术呈现井喷式发展,尤其是2019年之后,PROTAC呈指数增长。同时,国内PROTAC也处于上升期,近年在创新环境的驱动下,中国PROTAC专利申请数量较高,目前总量位居全球第四位,仅次于美国、欧洲和加拿大。随着研究的进步,蛋白质降解技术除了PROTAC技术,还包括分子胶、LYTAC、AUTAC、 ATTEC、 AbTAC、dTAG、PhotoTAC等技术。分子胶与PROTAC的区别在于E3连接酶ligand、linker和Targeted protein ligand三组分的大小不同。其他蛋白质降解技术分子结构也相似,如LYTAC技术,LYTAC分子一端链接细胞表面跨膜受体结合的ligand,另一端链接靶蛋白结合的抗体或小分子,LYTAC分子通过细胞膜胞吞作用形成胞内囊泡,最终运输到溶酶体内降解掉。冯博士介绍到,由于PROTAC等蛋白质降解技术能精准靶向、降解目标蛋白,研究者认为“万物皆可降”。
从PROTAC药物设计角度,冯博士提出了三个设计策略:首先是靶向蛋白降解E3连接酶和配体的选择,对于PROTAC分子能否实现精准靶向至关重要。目前体内的E3连接酶有600多种,其中用于PROTAC药物研发的相对较少,最常用的E3连接酶有CRBN、VHL、cIAP和MDM2,常见的E3连接酶配体(如图1);其次是靶向蛋白的选择。PROTAC药物开发是小分子抑制剂开发工作量的3倍,选择策略首先考虑选择小分子抑制剂难以开发或难以达到预期效果的难成药靶点,凸显PROTAC药物的优势。第二是选择具有多重功能的蛋白靶点,小分子抑制剂可能抑制其部分功能,而抑制全部功能则需要通过降解来实现。第三是选择具有高变异性的蛋白靶点,冯博士指出如果只是单纯抑制,很容易因为变异而产生耐药性。三种策略的优劣(如表1)。目前PROTAC药物开发的靶点约有二百多个,主要针对肿瘤治疗。
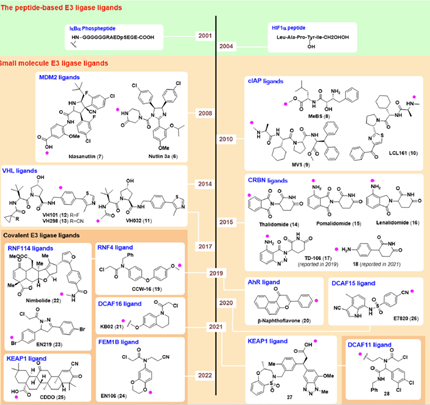
图1 常见E3连接酶的配体[1]
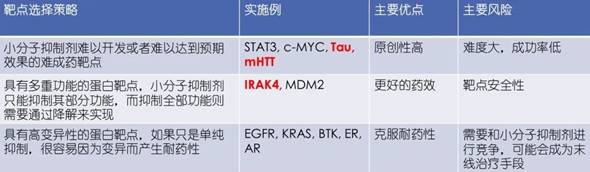
表1 药物设计三种策略优劣势对比
截至2022年10月,全球已经或即将进入临床的PROTAC靶向蛋白降解剂有22个,国外和国内分别为15个和7个,国内在研公司包括百济神州、海思科、海创等。全球进入临床的分子胶降解剂共有9个,分子胶技术相对国外而言,国内发展相对缓慢。但更多的制药公司正在加入蛋白质降解研究队列,如康朴和标新等,在未来几年国内会有更多蛋白质降解剂提交临床申请。
虽然PROTAC药物早期研发取得了初步成效,但PROTAC要进入临床仍然面临巨大的挑战,PROTAC分子很难符合成药五规则要求,研究者需考量水溶性和脂溶性平衡、Linker的刚柔长短问题、分子透膜性、体内代谢稳定性问题等等。而神经退行性疾病药物研发因血脑屏障问题面临着更大的挑战。目前,Arvinas公司开发的PROTAC降解剂已成功穿透血脑屏障,并且正在开展包括靶向阿尔兹海默症的相关的Tau蛋白、帕金森病相关的α-突触核蛋白、以及亨廷顿病相关的mHTT蛋白等PROTAC降解剂。Arvinas公司研发的PROTAC降解剂有望成为治疗神经退行性疾病的新型靶向药。
从PROTAC药物临床试验结果来看,PROTAC药物未来前景可期。冯博士指出,PROTAC开发已经解决了药物的成药性问题,安全性可控,同时克服了已有治疗方法的耐药性问题,加之PROTAC药物可靶向“难以成药”靶点的特点,PROTAC具有成为Best in Class的潜力。

▲冯焱博士在现场报告
2
蛋白质积聚与神经退行性疾病:机制与靶点?
胡红雨教授从蛋白质积聚的基础研究出发阐述了解析神经退行性疾病的发病机制,介绍了团队提出的“募集假说”(Sequestration Hypothesis),为神经退行性疾病的药物设计与开发提供了新的思路。
众所周知,生物信息的传递必须精确和保真。根据中心法则,从DNA到RNA再到蛋白质合成,碱基和三联体密码可实现精准配对;但是蛋白质从一级序列到三维结构的折叠加工时,由于加工过程复杂蛋白质会发生错误折叠。正确折叠的蛋白质可释放到细胞质中发挥功能,而错误折叠的蛋白质将转运到蛋白酶体或者溶酶体中降解掉,折叠错误但未降解的蛋白质则在细胞质中积聚(Aggregation),形成淀粉样(Amyloid-like)或块状包涵体(Inclusion Bodies),这种蛋白质积聚现象与神经退行性疾病紧密相关。常见的有Aβ和Tau蛋白积聚,它们与阿尔茨海默病(AD)和唐氏先天愚综合症(DS)相关;突触核蛋白积聚与帕金森症(PD)和AD相关,其他蛋白质与神经性疾病相关见表2。在淀粉样蛋白和包涵体中除了含有积聚的蛋白质还含有泛素和分子伴侣等生物分子。

表2 蛋白质积聚与神经退行性疾病关系
蛋白质积聚是否为导致神经退行性疾病的诱因?由于治疗AD药物临床试验屡次失败,引起了研究者对Aβ蛋白作为治疗AD药物的靶标表示怀疑。Aβ 斑块和Tau积聚究竟是不是治疗阿尔茨海默病的有效靶点有待确证,但根据目前研究结果,胡教授提出研究者需要重新思考以下几个问题:第一是AD和PD疾病的复杂性问题,可能存在其他发病诱因;第二是Aβ假说合理性问题,Aβ积聚是AD发生的原因还是结果,不同机制药物研发思路不同;第三,蛋白质积聚毒性或致病性问题,蛋白质积聚如何产生毒性或如何积聚?此外,还需思考AD疾病是否有替代的机制模型等问题。针对这些思考问题,胡教授提出了团队需要解决的研究问题:蛋白质为什么会发生错误折叠和积聚?蛋白质错误折叠和积聚对细胞的影响?如何清除蛋白质积聚物/包涵体?
为解决这些科学问题,胡教授团队开展了一系列研究工作,避开了存在争议的Aβ和Tau蛋白,选择了机制相对明确的PolyQ /A蛋白和RNA-结合蛋白(RBP)两类蛋白质为研究对象,并试图揭示这些PolyQ/A类蛋白家族和RBP蛋白家族蛋白的积聚和致病机制。PolyQ是一种含有连续的谷氨酰胺的蛋白质序列,如果序列中谷氨酰胺延伸超过一定数量则会引起蛋白质积聚,研究表明PolyQ蛋白积聚与多种神经退行性疾病的发生相关。胡教授在开展PolyQ蛋白积聚研究中发现,Htt蛋白积聚同时会引发HYPA蛋白从细胞核内向细胞质中转移并发生积聚形成包涵体[2]。回顾2006年Shults C.W.对PD发病机制的研究,发现细胞内包涵体中不仅发现a-突触核蛋白的积聚,还会募集Synphilin-1、泛素-蛋白酶体组分、分子伴侣、P62/Sequestosome 和Tau蛋白[3]。在胡教授团队开展的一系列研究中均发现,蛋白质积聚同时会募集其特异相互作用的蛋白质进入包涵体,如PQE Atx3(一种去泛素化酶)蛋白积聚会招募P97/VCP4;PQE Atx7 蛋白的积聚募集USP22(一种组蛋白去泛素化酶)[5];PQE Htt 蛋白的积聚会募集泛素接头蛋白(Ub Adaptors)到包涵体[6],并引起下游功能的损伤。此外,团队研究发现TDP-43蛋白积聚也存在募集作用,TDP-43的N-端被细胞凋亡蛋白酶切除形成TDP-35,随即从细胞核中转移到细胞质中形成包涵体。TDP-35会募集TDP-43从细胞核到细胞质中的包涵体内[7、8],加速蛋白质积聚。除此之外,Tau蛋白积聚也可募集LSD1(组蛋白去甲基化酶)从细胞核转移到细胞质中[9]。综合研究结果,团队得出了结论:蛋白质积聚过程募集其特异相互作用的蛋白质,从而引起细胞功能丧失并产生细胞毒性或神经退行性[10]。胡教授团队总结了文献报道的蛋白质积聚所募集的相关蛋白质[11],提出蛋白质积聚过程需要满足的三个条件:蛋白质积聚(Protein Aggregation)、蛋白质之间特异相互作用(Specific Interaction)和挟持效应(Hijacking Effect)。基于蛋白质相互作用模式,胡教授团队将募集作用划分为共积聚(Co-aggregation)、特定结构域或模体介导、RNA 介导、对分子伴侣等四类募集作用方式[10、12]。其中,特定结构域或模体介导的募集作用最常见的,泛素介导的募集作用也属于此类。另外,团队研究还揭示了蛋白质募集作用需要具备蛋白质积聚的核心元件和能够相互作用的结构域或模体。
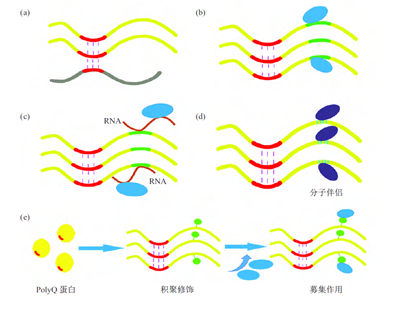
图2 PolyQ 积聚蛋白的4 种募集作用方式[12]
根据这些研究成果,胡教授团队提出了“募集假说(Sequestration Hypothesis)”,即蛋白质积聚通过募集其特异相互作用的蛋白质,从而引起细胞功能丧失并引起细胞毒性或神经退行性疾病的发生[10]。与传统观点不同,“募集假说”提出了一种全新的蛋白质致病性的机理。传统生物学认为,某些疾病的产生是由基因突变引起的,而“募集假说”认为在基因突变到疾病发生的过程中,引进了蛋白质积聚和募集的重要决定作用,认为某些神经退行性疾病是由蛋白质积聚和募集所产生的。
针对神经退行性疾病的机制研究和靶点开发,胡教授提出了三方面的思考:第一、明确蛋白质积聚与神经退行性疾病发生的因果关系至关重要,只有明确关系药物开发才能明确靶标研究方向。Aβ和Tau蛋白积聚与神经退行性疾病的因果关系尚不明确,基于该机制的药物研究极具挑战,而PolyQ延伸导致疾病产生的机制明确,可作为神经退行性疾病的潜在靶点;第二、可溶性蛋白质和积聚蛋白质理化性质的不同,相比可溶性蛋白质靶点,蛋白质积聚物或包涵体难以被打开,常规的蛋白质降解途径可能难以将其有效降解。因此,由于积聚蛋白质具有不同的理化性质,通过降解蛋白质积聚的药物开发面临着巨大挑战,需要探索崭新的思路;第三、蛋白质积聚导致细胞毒性有待研究。蛋白质积聚为什么产生细胞毒性?处于哪种状态可产生细胞毒性?目前尚未明确。
基于神经退行性疾病的机制和靶点的思考,胡教授提出了探讨神经退行性疾病的研究思路:第一、由于神经退行性疾病的机制复杂、研究比较困难,可从非中枢神经系统退行性疾病着手开展蛋白质积聚机制研究,如从肌肉神经疾病挖掘蛋白质积聚与神经性疾病的作用机制,进而进行新药研发;第二、根据蛋白质积聚“募集假说”,可尝试降低积聚蛋白质量或阻断募集其他相互作用蛋白质的药物设计和研发思路。

▲胡红雨教授在现场报告
参考文献:
[1]. Cao-C et al., Chem. Soc. Rev., 2022, 51, 7066–7114
[2]. Jiang-YJ et al.,J Biol Chem, 2011, 286,25236-25245
[3]. Shults CW,. PNAS, 2006,103, 1661-1668
[4]. Yang-H, et al.,Sci Rep, 2014,4,6410
[5]. Yang-H, et al., JBC, 2015,290,21996-22004
[6]. Yang H, et al., FASEB J,2018, 32,2923-2933
[7]. Che-MX,et al., FEBS Lett, 2015, 589, 1920-1928
[8]. Jiang-LL, et al., J Cell Sci, 2022, 135, 259380
[9]. Engstrom-AK, et al., PNAS, 2020, , 117, 29133-29143
[10]. Yang-H & Hu-HY,FEBS J,2016,283,3705-3717,Review
[11]. Hu-HY & Liu-YJ, BBA-MCR,2022, 1869,119360, Review
[12]. 岳宏伟, 胡红雨*,多聚谷氨酰胺延伸蛋白募集细胞内正常蛋白质或RNA的分子机制。生物化学与生物物理进展,2018, 45(12): 1204-1213.
下期预告
12月中下旬将举办第45期Science Café 活动,聚焦“细胞治疗”,敬请关注!