GLP-1药物的成功对现有NASH在研药物是打击还是利好?尽管有一些NASH药物的积极数据出来,但与礼来的triple G仍然差距甚远。
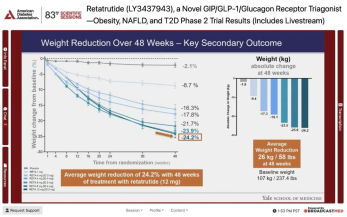
礼来的在研GLP-1/GIP/glucagon激动剂(俗称“triple G”)retatrutide,用48周减重24.2%的2期数据结果,为减肥药树立了一个新标杆。这个数据超过了礼来自己的另一款药物Mounjaro(72周减重22.5%)和诺和诺德的Wegovy(68周减重约16%)。
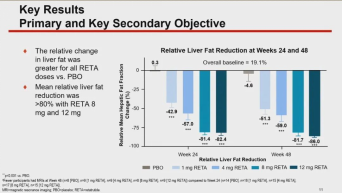
但更让我们关注到的,是retatrutide的非酒精性脂肪性肝病(NAFLD)患者亚组分析数据。研究中,肝脏脂肪超过10%的患者纳入了预先指定的NAFLD亚组。24周后,接受每周8mg和12mg剂量的retatrutide的患者中, 80%以上多余的肝脏脂肪完全消失。
来源|2023 ADA
礼来的首席科学和医疗官Dan Skovronsky在发布数据时评论,“将glucagon受体激动剂、GIP和GLP-1受体激动剂联合可能是retatrutide取得这个体重减轻数据的原因之一”。他还补充说,最新的数据“让我们有信心进一步在3期研究中探索retatrutide的潜力,这项研究将不仅评估减重,而是全面治疗肥胖及其并发症”。
消息公布后,礼来的股价在本周二上涨2.6%,而从事非酒精性脂肪肝( NASH,由NAFLD发展而成的严重形式)药物研发的公司——Madrigal Pharmaceuticals (MDGL) 和 Viking Therapeutics (VKTX) 的股价应声暴跌13.3%和18.2%。国内专注NASH新药研发的拓臻生物股价更是下跌了23.5%。其他NASH概念股也都齐齐下跌。
NASH药物还值得开发吗?
retatrutide在NASH上的优异表现,是导致NASH概念股齐齐下跌的关键原因。作为一种常见的代谢疾病,截止目前全球尚无针对NASH的药物获批上市,而相关在研产品又屡屡折戟。
虽然上个月FDA拒绝了Intercept公司的FXR激动剂奥贝胆酸用于NASH 纤维化的适应症批准,但同期Madrigal和Viking发布的积极数据,又给大家带来了希望。
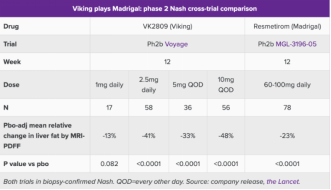
欧洲肝脏研究协会年会(EASL)上,Madrigal继去年12月后再次公布了THR-β受体激动剂resmetirom的积极数据,并表示即将在本月底提交上市申请。尽管面临更改主要终点的质疑,但Madrigal发布的基于核磁共振对肝脏脂肪水平的评估显示,接受剂量为每日100 mg的resmetirom治疗52周后,患者肝脏脂肪水平平均降低51%。
Viking的同机制药物VK2809 于5月发布的2b期数据显示,最高剂量组(10mg QOD)治疗3个月后肝脏脂肪减少达到了48%。
来源|Evaluate
然而这些数据与retatrutide相比,差距甚远,因此直接导致股价暴跌。
当前正在研发的NASH药物主要针对脂肪变性、炎症和纤维化。FXR激动剂、THR激动剂和GLP-1受体激动剂是最主要的三类在研的NASH药物。那么,在retatrutide取得成功,证明triple G在NASH上的巨大潜力后,是否意味着非GLP-1类药物在NASH的开发上前景暗淡呢?
对此,有行业专家表示,非GLP-1类药物也许可以尝试开发抗纤维化药物,作为一种差异化开发路径。
目前除了礼来的retatrutide,就只有韩美的一款triple G药物efocipegtrutide在尝试开发NASH适应症。或许不远的将来,triple G将成为又一众多生物制药企业争相追逐的热点领域。
毒性问题仍是困扰
然而,与其他肠促胰岛素(incretin)一样,retatrutide的副作用仍让人担忧。
retatrutide的2期研究数据中,高剂量组(12mg)有16%的患者因副作用而退出治疗。这个数据高于Mounjaro(15mg,4%)和Wegovy(2.4mg,4%)。
问题产生了:监管方和患者到底能够耐受多大的毒性?
当然,retatrutide的数据来自于2期研究,试验人数更少,而Mounjaro和Wegovy的数据来自后期、规模更大的3期研究。但是,再好的减重效果只有在患者能够耐受药物的情况下才有可能实现。
据Evaluate的比较,与Mounjaro和Wegovy相比,retatrutide的恶心和呕吐比例更高,皮肤过敏发生率达到7%,这些都需要进一步加以评估和治疗。此外,高剂量组中还有1名患者出现了心电图QT间期延长,虽然可能与患者服用昂丹司琼治疗恶心有关,但仍需要引起关注。
对此,报告数据的耶鲁大学医学院Ania Jastreboff 博士表示,retatrutide剂量递增方案仍在优化中,3 期试验有可能会使用较慢的递增方案,且后续3期试验的剂量尚未确定。
事实上,其他GLP-1类药物也报告过类似的安全性问题。
在本届ADA会议上,勃林格殷格翰的GLP-1/glucagon受体双重激动剂survodutide的2期数据显示,最高剂量组(4.8mg)有24.6%的患者因不良反应而停止治疗,停药主要发生在剂量快速递增阶段,且大多是由于胃肠道反应。
辉瑞宣布,因在研究中发现转氨酶升高,决定放弃口服GLP-1受体小分子激动剂药物lotiglipron的开发,而选择继续另一款GLP-1小分子danuglipron的临床试验。但在此前2期糖尿病患者的研究中,danuglipron出现了与retatrutide类似的QT间期延长事件,提示这类药物有可能会引起心律问题。
end.
文章、图片来源:研发客公众号
如有侵权,请后台联系小编删除